15% Early Bird discount until 31 Oct 2025
MDR Medical Device Conformity Assessment Training
Practice-oriented, 10-month training
Starting Date: 30 January 2026

Nem túlzás azt állítani, hogy az MDR számos korábbi anomáliának üzent hadat, amikor a klinikai értékelést az orvostechnikai eszközök megfelelőségértékelésének fókuszába helyezte.
Már az MDR rendeletet megelőzően is történtek lépések az objektív bizonyítékokon alapuló klinikai igazolási gyakorlat bevezetésére. A nagy lépést a MEDDEV 2.7/1 rev. 4 iránymutatás jelentette, azonban még mindig sok a nyitott kérdés.
Egy dolog biztos: az MDR rendelet a klinikai értékelés követelményeinek meghatározásakor a legkritikusabb jellemzőjű eszközöket vette alapul.
Nézzük meg, milyen követelményeket fogalmaz meg az MDR szerinti a klinikai értékeléssel szemben!
A jogszabályi követelmény meglehetősen szűkszavú: az MDR rendelet 61. cikk 3) bekezdése.
„61. cikk (3) A klinikai értékelést meghatározott és módszertani szempontból megalapozott eljárás keretében kell elvégezni, amelynek az alábbiakon kell alapulnia:
a) az eszköz biztonságosságára, teljesítőképességére, tervezési jellemzőire és rendeltetésére vonatkozó, aktuálisan rendelkezésre álló releváns tudományos szakirodalom kritikai értékelése, amelynek során teljesülniük kell a következő feltételeknek:
— bizonyítást nyer, hogy az eszköz, amelynek rendeltetése klinikai értékelés tárgyát képezi, a XIV. melléklet 3. pontjának megfelelően egyenértékű azzal az eszközzel, amelyre az adatok vonatkoznak, valamint
— az adatok megfelelően bizonyítják a biztonságosságra és teljesítőképességre vonatkozó általános követelményeknek való megfelelést;
b) az összes rendelkezésre álló klinikai vizsgálat eredményének kritikai értékelése, megfelelően figyelembe véve azt, hogy a vizsgálatokat a 62–80. cikk, a 81. cikk alapján elfogadott bármely jogi aktus és a XV. melléklet szerint végezték-e; és
c) az adott célra aktuálisan rendelkezésre álló alternatív kezelési lehetőségek mérlegelése, amennyiben vannak ilyenek.”
[Forrás: MDR, 61. cikk (3)]
Nyilvánvaló gyártói törekvés, hogy (gazdaságilag) ésszerű elvárásokat támasszanak saját termékeik klinikai értékelésekor. A gyártónak saját szabályozást kell kidolgoznia a klinikai értékelés megtervezésére, végrehajtására, értékelésére, ellenőrzésére, dokumentálására és klinikai adatok gyűjtésére. Ennek a szabályozásnak illeszkednie kell az MDR rendelethez a klinikai vizsgálatokra vonatkozó jogszabályi követelményekhez, szabványkövetelményekhez (ISO14971), és a már megjelent iránymutatásokhoz.
A szabályozások a gyártónál kötelezően működtetett minőségirányítási rendszerének részét képezik, jellemzően minőségirányítási eljárások.
A kidolgozott eljárás az annak alapján készült klinikai értékeléssel együtt igazolja a jogszabályi követelmények teljesülését. Nyilvánvaló kölcsönhatás: minél részletesebb az eljárás, annál koncentráltabb lehet maga a klinikai értékelés és fordítva, ha az eljárás nagyon vázlatos, a klinikai értékelésnek részletes indoklásokat kell tartalmazniuk.
A klinikai értékelés során az eszközre vonatkozóan rendelkezésre álló releváns klinikai adatok gyártó általi azonosítása, elemzése és értékelése történik meg annak érdekében, hogy kiderüljön, hogy vajon azok megfelelő klinikai bizonyítékul szolgálnak-e az eszköz biztonságosságára és teljesítőképességére vonatkozó általános követelmények megfelelőségének igazolásához.
Ha a gyártó által meghatározott klinikai bizonyíték szintjének nem felelnek meg az eszközről rendelkezésre álló klinikai adatok, akkor további klinikai adatok gyűjtése és értékelése szükséges.
A klinikai bizonyíték szintjének azok az adatok nem felelnek meg, amelyek nem igazolják az eszköz biztonságosságára és teljesítőképességére vonatkozó általános követelmények teljesülését.
A klinikai adatok forrása lehet:
származó klinikai szempontból releváns adatok.
Ha a klinikai bizonyíték szintje megfelel, akkor a klinikai adatok értékelésének eredményeit dokumentálni kell a klinikai értékelési jelentésben, vagyis el kell készíteni az orvostechnikai eszközre vonatkozó klinikai értékelést, amely megfelelősége esetén az eszközre a CE-jelölés feltehető, és az eszköz jogszerűen forgalomba hozható. (Fontos tudnivaló: az I. kockázati osztályú termékeknél magasabb osztályba sorolt eszközök esetében a termékek gyártóinak a klinikai értékelést megfelelőségértékelést végző, az arra kijelölt bejelentett szervezettel is felül kell vizsgáltatniuk.)

1. ábra: A klinikai értékelés 5 lépése a MEDDEV 2.7/1 rev. 4. alapján
Forrás: a MEDDEV 2.7/1 rev. 4. alapján a Szerző által készített ábra
0. lépés:
A klinikai értékelési folyamat 0. lépése bemutatja az értékelés hatókörét és a vizsgálati környezetet, ideértve, hogy mely termékekre/modellekre/beállításokra terjed ki a klinikai értékelés. Bemutatja azt a műszaki tartalmat, amin az eszköz alapszik, az alkalmazási feltételeket és az eszköz tervezett célját. Tartalmazza mindazokat a nyilatkozatokat, amelyek az eszköz klinikai teljesítményére vagy a klinikai biztonságosságára vonatkoznak.
1. lépés:
A klinikai értékelési folyamat 1. lépése a sarkalatos adatok azonosítása, amely elmagyarázza az irodalom kutatásának stratégiáját, és bemutatja a kijelölt klinikai adatok és a vonatkozó preklinikai adatok természetét és terjedelmét.
2. lépés:
A klinikai értékelési folyamat 2. lépése a sarkalatos adatok megítélése, amely bemutatja az értékelők által az adathalmazok megítélésekor felhasznált kritériumokat, összefoglalja a sarkalatos adathalmazokat (módszereket, eredményeket, a szerzők következtetéseit), és értékeli a módszertani minőséget, a tudományos érvényességet, az értékelésnél betöltött szerepét, a bizonyítékokhoz társított súlyozást, és az esetleges korlátokat, továbbá megindokolja bizonyos adatok vagy dokumentumok elutasítását. A sarkalatos adatoknak olyan minőségűeknek kell lenniük, amelyek a vizsgált eszköz megfelelő klinikai teljesítőképességének és klinikai biztonságosságának igazolásához szükségesek. A sarkalatos adatokat vagy a vizsgálat alatt álló eszközzel, annak rendeltetésszerű használata során, vagy egy azzal ekvivalens eszközzel hozzák létre.
3. lépés:
A klinikai értékelési folyamat 3. lépése a klinikai adatok elemzése, amely bemutatja, hogy a referenciaként felsorolt információ (például a harmonizált szabványokban szereplő és a klinikai adatokra vonatkozó követelményeknek való megfelelés bizonyítása) és a klinikai adatok alkotnak-e, és ha igen, hogyan alkotnak elegendő klinikai bizonyítékot a vizsgálat alatt álló eszköz klinikai teljesítőképességére és klinikai biztonságosságára. A klinikai adatok elemzése bemutatja azt is, hogy megfelelő adatok állnak-e rendelkezésre a rendeltetési cél összes szempontjához és a klinikai értékelés által áttekintett összes termékre/modellre/beállításra. Az elemzés ismerteti az eszköz előnyeit és kockázatait (ezek természetét, valószínűségét, mértékét, időtartamát és gyakoriságát), és bemutatja az előny/kockázat profil elfogadhatóságát a jelenlegi ismeretek/az érintett orvosi szakterületeken a tudomány jelenlegi állása szerint. Az elemzésnek hivatkoznia kell az alkalmazandó szabványokra és útmutatókra, az elérhető kezelési alternatívákra, és azt a következtetést kell alátámasztania, hogy teljesül az eszköz klinikai tulajdonságaira vonatkozó összes általános követelmény.
4. lépés:
A klinikai értékelési folyamat 4. lépése a klinikai értékelési jelentés véglegesítése. A klinikai értékelő jelentés összefoglalja a teljes műszaki dokumentációban rögzített vagy hivatkozott valamennyi releváns klinikai adat értékelését. A klinikai értékelési jelentés és a vonatkozó klinikai adatok képezik a megfelelőségértékeléshez szükséges klinikai bizonyítékot.
Az MDR XIV. melléklete ugyancsak 5 elemet azonosít a klinikai értékelésben:
a) Klinikai értékelési terv kidolgozása és naprakésszé tétele a tudomány jelenlegi állásának figyelembevételével.
b) Az eszköz és rendeltetése szempontjából releváns, rendelkezésre álló klinikai adatok, illetve a klinikai bizonyítékok hiányosságainak azonosítása, mégpedig a szakirodalom szisztematikus áttekintésével.
c) Valamennyi releváns klinikai adat értékelése abból a szempontból, hogy mennyiben alkalmasak az eszköz biztonságosságának és klinikai teljesítőképességének meghatározására.
d) Megfelelően megtervezett klinikai vizsgálatok útján, a klinikai fejlesztési tervnek megfelelően olyan új vagy további klinikai adatok előállítása, amelyek szükségesek a lezáratlan kérdések megoldásához.
e) Valamennyi releváns klinikai adat elemzése, hogy következtetni lehessen az eszköz biztonságosságát és klinikai teljesítőképességét – ezen belül többek között a klinikai előnyeit –illetően
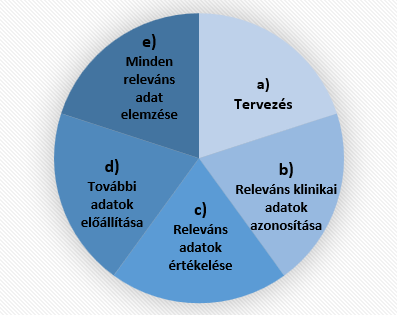
2. ábra: A klinikai értékelés 5 lépése az MDR XIV. melléklete alapján
Forrás: az MDR XIV. melléklete alapján a Szerző által készített ábra
A klinikai adatok értékelését a gyártónak meg kell terveznie, méghozzá egy ún. klinikai terv elkészítésével. A klinikai értékelési tervre (Clinical Evaluation Plan, CEP) vonatkozóan az MDR rendelet XIV. melléklet A. rész 1. pontja határoz meg követelményeket.
A gyártónak klinikai értékelési tervet kell kidolgoznia és naprakészen tartania, amely az adatok szisztematikus és elfogulatlan megítélésének biztosításához szükséges, leírja a megítélés folyamatát, és az ahhoz felhasználandó kritériumokat.
A klinikai értékelési tervnek a műszaki dokumentáció tartalmának részét kell képeznie.
A klinikai értékelési terv (CEP) tartalmára vonatkozó követelmények a következők:
IV. A Klinikai Értékelési Terv (CEP) tartalmi ellenőrzése
A klinikai értékelési terv tartalmára vonatkozóan ellenőrizni kell, hogy rendelkezésre áll-e minden orvostechnikai eszköz esetén a klinikai értékelési terv.
Emellett azt is ellenőrizni kell, hogy a klinikai értékelési terv tartalma megfelel-e az MDR rendelet XIV. melléklet A. rész 1. pont a) bekezdése követelményeinek.
A klinikai értékelési terv folyamatos naprakésszé tételét és azt is ellenőrizni kell, hogy a klinikai értékelési terv a műszaki dokumentáció részét képezi-e.
Továbbá azt is ellenőrizni kell, hogy a Legacy device-ok („öröklött eszközök”) esetén elvégezték-e az MDR rendelet szerinti „gap-elemzést” az MDCG 2020-6 útmutató [„Regulation (EU) 2017/745: Clinical evidence needed for medical devices previously CE marked under Directives 93/42/EEC or 90/385/EEC A guide for manufacturers and notified bodies”] I. mellékletének megfelelően, és ez alapján elkészítették-e a klinikai értékelési tervet. Ennek a tervnek magában kell foglalnia az alternatív kezelési lehetőségek újraértékelését, a releváns klinikai adatok újraértelmezését, azt, hogy adott esetben az egyenértékűség igazolása még megfelelő-e, és figyelembe vette-e a gyártó a PMS során gyűjtött tapasztalatokat, panaszokat az eszközzel kapcsolatban.
A klinikai értékelési tervnek az alábbiakat kell tartalmaznia:
A gyártónak fel kell mérnie, azonosítania, elemeznie és értékelnie kell a klinikai adatokat (a korábbi bekezdésekben rögzítettek szerint). A meghatározott adatok relevanciáját és bármiféle korlátját igazolnia kell a biztonságosságra és teljesítőképességre vonatkozó általános követelményeknek való megfelelés, illetve a kockázatelemzés szempontjai szerint. A gyártónak azonosítania kell az eszköz szempontjából fontos összes klinikai adatot, a kedvezőt és kedvezőtlent egyaránt, és megfelelően megalapozott, reprodukálható és szisztematikus keresési stratégiát kell alkalmaznia. A tervezett biztonságosságot, a beteget szolgáló előnyöket, és a klinikai teljesítőképességet klinikai adatokkal kell igazolni.
A gyártónak meg kell határoznia a konstrukciós jellemzőket, és az eszköz rendeltetési célját ahhoz, hogy demonstrálja minden egyes releváns, általános követelménynek való megfelelést. A gyártónak el kell végeznie az eszközre vonatkozó releváns tudományos szakirodalom és a biztonságosságra, előnyökre, teljesítményre, konstrukciós jellemzőkre, és rendeltetési célra vonatkozó adatok kritikai értékelését.
A klinikai adatok elemzése és értékelése során az elfogadható kockázat/előny profilt, teljesítményre vonatkozó követelményeket, és a nemkívánatos mellékhatások elfogadhatóságának követelményeit megfelelő klinikai bizonyítékkal kell alátámasztani az eszköz megfelelőség-értékelése során.
A klinikai értékelésnek bizonyítania kell, hogy a rendeltetési céllal összefüggő kockázatok minimálisak, az előnyökhöz képest elfogadhatóak és magas szinten biztosított az egészség és biztonság védelme.
A használati útmutatónak megfelelően ismertetnie kell az eszköz tervezett felhasználási célját és ezt elegendő klinikai bizonyítékkal kell alátámasztania. A használati útmutatónak helytálló információt kell tartalmaznia a hibás használat kockázatának csökkentésére, tájékoztatnia kell a fennmaradó kockázatokról és azok kezeléséről, és ezt elegendő klinikai bizonyítékkal kell alátámasztania. A pozitív hatásnak, amivel az eszköz befolyásolja az egyén egészségét, a beteg számára relevánsnak és mérhetőnek kell lennie. Tekintetbe kell venni az előnyök természetét, mértékét, valószínűségét és tartósságát.
Ilyen előnyök lehetnek például:
A kockázatirányítási dokumentumoknak meg kell határozniuk az eszközzel kapcsolatos kockázatokat, és ezek kezelését. A klinikai értékelésnek tárgyalnia kell azon kockázatok jelentőségét, amelyek még fennmaradtak, miután a gyártó már a kockázatok csökkentésre tett intézkedéseket.
Az eszköz előny/kockázat profilja elfogadhatóságának értékelésénél több szempontot kell mérlegelni:
Azonosítani kell tehát, és meg kell határozni a jelenlegi ismereteket a tudomány jelenlegi állását, vagyis az ide tartozó eszközöket és célközönség számára elérhető alternatív kezelési lehetőségeket beleértve.
Az eszközök esetén igazolni kell, hogy teljesíti azokat a paramétereket, és teljesíti azt a célt, amelyet a gyártó meghatároz.
Ebbe beletartoznak az emberekre gyakorolt bármilyen közvetlen és közvetett egészségügyi hatások, illetve a betegeknél jelentkező klinikai terápiás és diagnosztikai előnyök, amelyek az eszköz rendeltetésszerű használata esetén annak műszaki vagy funkcionális tulajdonságaiból származnak. (Ilyen teljesítményadat például a független képalkotási irányok száma, a képfeldolgozás reprodukálhatósága, továbbá egy teszt diagnosztikai szenzitivitása és specificitása a legfontosabb klinikai indikációkban.)
Bármely nem kívánatos mellékhatásnak elfogadható kockázatot kell képviselnie a tervezett teljesítményhez képest.
A mellékhatások elfogadhatóságának értékeléséhez, az esetleges nemkívánatos mellékhatások természetének, súlyosságának és gyakoriságának értékeléséhez klinikai adatokra van szükség. A mellékhatások elfogadhatóságának megítéléséhez a klinikai adatoknak megfelelő számú megfigyelésen kell alapulniuk, és tekintetbe kell venni a tudomány aktuális állását. Az elfogadhatóság megítélésében tekintettel kell lenni a betegek rendelkezésére álló jelenlegi kezelési alternatívákra, és a vonatkozó szabványokban és útmutatásokban rögzített objektív teljesítmény-kritériumokra. Ha hiányoznak a klinikai adatok, vagy nincs elegendő számú megfigyelés, az eszköz nem felel meg a nemkívánatos mellékhatások elfogadhatóságára vonatkozó követelménynek.
Szerzők: Markóné Németh Tímea (NoBoMed Zrt.) és Balázs György (EMKI-Cert Kft.)
Részlet a NoBoVersum Zrt. MDR orvostechnikai megfelelőségértékelő képzése tananyagából.
Practice-oriented, 10-month training
Starting Date: 30 January 2026